
Doktor nauk medycznych i nauk o zdrowiu w dyscyplinie nauki medyczne, magister biotechnologii molekularnej. Adiunkt w Katedrze Biotechnologii i Biologii Komórki WSIiZ. Jego zainteresowania naukowe koncentrują się wokół molekularnych podstaw neurodegeneracji i patogenezy choroby Alzheimera związanego z wiekiem. Dodatkowym polem badawczym jest badanie właściwości nanocząstek, ich pułapkowania w liposomach, wykorzystania w terapii przeciwnowotworowej, kierunkowania działania toksycznego nanocząstek bezpośrednio w struktury zmienione nowotworowo oraz metody kolokalizacji związków z użyciem konfokalnej mikroskopii fluorescencyjnej.
Nanocząstki srebra – rewolucja, czy zagrożenie?
Nanocząstki srebra – często w literaturze fachowej określane skrótem AgNPs – są bardzo małymi formami zredukowanego srebra (Ag0). Syntezą, charakterystyką oraz modyfikacją tego typu nanostruktur zajmuje się obecnie nowa, interdyscyplinarna dziedzina na pograniczu biologii, chemii, czy fizyki – nanotechnologia (łac. nano – karłowaty, mały; logos – nauka). Co ciekawe, aby dany typ srebra zaliczyć do nanocząstek, przynajmniej jeden jej rozmiar (spośród x, y, z), musi mieścić się w zakresie 1 – 100 nanometra (nm). W tym miejscu warto nadmienić, że jeden nanometr to 10-9 m. Dużo łatwiej zwizualizować nanometryczne rozmiary nanocząstek w porównaniu do wartości referencyjnej, jaką jest włos ludzki – AgNPs są około tysiąc razy mniejsze od grubości ludzkiego włosa. Ta cecha nadaje nanocząstkom srebra unikatowe właściwości – fizyczne (w tym optyczne), chemiczne, a co za tym idzie determinuje ich zachowanie w układach biologicznych – bakteriach, komórkach, tkankach, czy narządach. Obecnie w literaturze szeroko opisane są różnorakie metody syntezy nanocząstek srebra o specyficznych kształtach – tj. nanosfer, nankwiatów, czy nanoprętów, które różnią się pomiędzy sobą reaktywnością (również aktywnością w układach biologicznych). Co istotne, główną cecha determinującą tego typu działanie jest rozmiar – udowodniono wielokrotnie, że im mniejsze nanocząstki srebra, tym silniejsze ich działanie biologiczne.
Zasadniczo, znane są dwa podejścia w otrzymywaniu nanocząstek – jest to odpowiednio sposób „top-down” oraz „bottom-up”. Pierwszy z nich obejmuje szereg metod – głównie fizycznych – które pozwalają na otrzymywanie AgNPs z materiałów makroskalowych srebra wskutek ich rozdrabniania, szlifowania, działania lasera itp. Są one historycznie starsze i pozwalają na uzyskanie nanostruktur o stosunkowo małych rozmiarach, jednak heterogennych pod względem wielkości. Odmienne podejście – tj. bottom-up – obejmuje niejako „budowanie” nanostruktur „atom po atomie” za pomocą – najczęściej – metod chemicznych [redukcja prekursora w postaci soli srebra np. azotanu (V) srebra – w obecności stabilizatora]. Podejście to pozwala na skuteczną kontrolę kształtu i wielkości AgNPs, włącznie z otrzymywania „tych najmniejszych” nanostruktur o wielkości 5 – 10 nm. Jednak, metoda ta uznawana jest za najmniej przyjazną środowisku – wymaga ona stosunkowo dużych nakładów energetycznych oraz – co istotniejsze – konieczności utylizacji toksycznych reagentów pozostałych po reakcji redukcji soli srebrowych, co stanowi znaczne obciążenie dla środowiska oraz eksperymentatora. Warto w tym miejscu opisać metody „zielonej chemii” (ang. green chemistry) – jako stosunkowo młodą alternatywę dla chemicznej redukcji. Podejście to pozwala na syntezę nanostruktur z wykorzystaniem reduktorów pochodzenia naturalnego, obecnych w bakteriach, drożdżach, a nawet ekstraktach roślinnych. Tego typu synteza stanowi obecnie najbardziej rozwijaną gałąź nanotechnologii – jako odpowiedź na zmieniające się warunki środowiskowe poprzez zmniejszenie ilości toksycznych substancji odpadowych po procesie syntezy AgNPs.

Fig. 1 – Zdjęcia wykonane transmisyjnym mikroskopem elektronowym (TEM) obrazujące morfologię nanocząstek srebra (czerwone strzałki). Zdjęcia wykonane: UJ w Krakowie na zlecenie Dr B. Skóra.
Całkowite zaprzestanie syntezy AgNPs nie jest obecnie możliwe, ze względu na coraz większe zainteresowanie tego typu nanostruktur w medycynie, gdzie szczególnie duże znaczenie przypisuje się ich antybakteryjnym właściwościom. Pomimo tego – w rzeczywistości pozytywne działanie AgNPs na jedne typy gatunków (np. bakterie, grzyby), nie odzwierciedla działania w innych (komórkach/tkankach ssaczych).
Dobre złego początki?
Początki badań naukowych nad wykorzystaniem nanocząstek srebra jako środka antyseptycznego sięgają XX wieku. Wtedy to zaobserwowano, że AgNPs mogą skutecznie niszczyć bakterie, nawet w nanogramowych stężeniach. Mechanizm działania antybakteryjnego (czasami bakteriostatycznego) zazwyczaj obejmuje trzy aspekty: bezpośrednie zniszczenie błon/ścian komórkowych, skutkując lizą bakterii, indukcję generacji jonów srebrowych wewnątrz cytoplazmy bakterii, czy bezpośrednią reakcją z materiałem genetycznym bakterii. Obecnie badania udowodniły zdolność AgNPs do niszczenia różnych typów bakterii m.in. Gronkowca złocistego (Staphylococcus aureus) – groźnego patogenu skórnego, Streptococcus mutans, który występuje naturalnie w jamie ustnej i jest uznawany za główny gatunek bakterii odpowiedzialny za powstawanie próchnicy, czy Pałeczki ropy błękitnej (Pseudomonas aeruginosa), która jest zdolna do wywoływania groźnych zakażeń u osób z obniżoną odpornością. Opisana zdolność nanocząstek srebra do niszczenia bakterii cechuje się nieselektywnością – co stanowi wartość dodaną, ale także jest przeszkodą w stosowaniu AgNPs na szeroką skalę. Na korzyść nanocząstek srebra przemawia uniwersalność działania tj. brak konieczności „dobierania” określonych nanocząstek do typu bakterii, jak ma to miejsce w przypadku antybiotyków (przypomnijmy, że występują różne antybiotyki, nie działające tak samo na różne rodzaje/gatunki/ a nawet szczepy bakterii!). Niestety, nieselektywność działania antybakteryjnego niesie ze sobą ryzyko związane m.in. z niszczeniem naturalnej flory bakteryjnej – korzystnej dla zdrowia i funkcjonowania człowieka.
Niemniej jednak, działanie antybakteryjne nanocząstek srebra jest wykorzystywane zwłaszcza w medycynie i antyseptyce. Obecnie na masową skalę produkowane są narzędzia i materiały (np. maski chirurgiczne) posiadające na swojej powierzchni AgNPs, ale także plastry na trudno gojące się rany. W tym miejscu należy wspomnieć, że wysoka reaktywność nanocząstek srebra w stosunku do bakterii oportunistycznych, występujących w niektórych typach ran, przynosi pozytywne efekty i znacznie przyspiesza rekonwalescencję. Co istotne wiele ostatnich badań naukowych pokazuje, że nanocząstki srebra są skuteczne w walce z bakteriami zaliczanymi do szczepów opornych, czy wielo-opornych (tzw. super bakterii) np. opornych na metycylinę szczepów Gronkowca złocistego (ang. methicillin-resistant Staphylococcus aureus, MRSA) – odpowiedzialnego często za występowanie tzw. „zakażeń szpitalnych”, czy wielo-opornego szczepu Prątka gruźlicy (ang. multi-drug-resistant Mycobacterium tuberculosis, MDR-TB).
Ze względu na – opisane powyżej – wysokie właściwości antybakteryjne, zwłaszcza w przypadku trudno gojących się ran, nanocząstki srebra zyskują na znaczeniu, sprawiając, że ekspozycja człowieka na tego typu nanostruktury znacząco wzrasta. Istotny jest tutaj fakt kontaktu AgNPs z przerwaną skórą, w efekcie czego nanostruktury te mogą migrować do głębszych warstw, przedostając się końcowo do krwioobiegu.
Nano – nie takie bezpieczne …
Potencjalne drogi narażenia człowieka na działanie nanocząstek srebra są związane m.in. z drogą przezskórną – jako skutek kontaktu AgNPs znajdujących się w plastrach z powierzchnią rany, co ułatwia dostęp do penetracji tych nanocząstek w głąb tkanek. Innym sposobem narażenia człowieka na działanie AgNPs jest droga pokarmowa (z pożywieniem), jako efekt bioakumulacji tego typu nanostruktur w środowisku – udowodniono obecność AgNPs w tkankach ryb w zakresie 9,144–53,784 mg/kg. Pomimo braku wystarczających badań klinicznych – powszechnie uznaje się, że zarówno ostre (jednorazowe pobranie/podanie wysokiej dawki), jak i chroniczne (powolne pobieranie/podawanie niskich dawek) narażenie na działanie AgNPs jest niebezpieczne dla człowieka. Wynika to przede wszystkim z mechanizmu działania tych nanostruktur w komórkach ssaczych – w tym ludzkich.
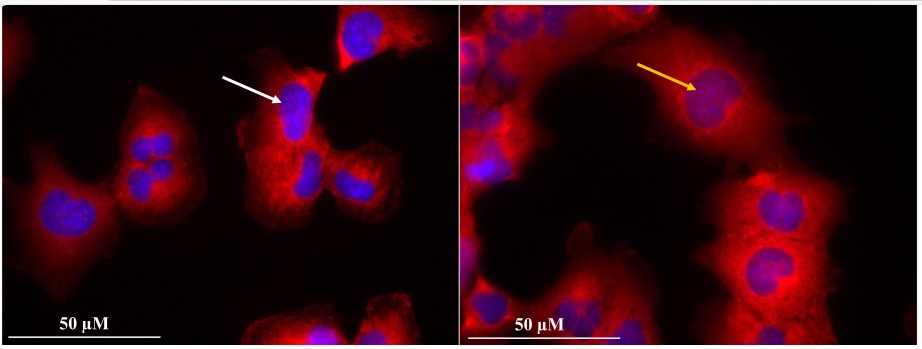
Fig. 2 – Zdjęcie wykonane mikroskopem konfokalnym, obrazujące translokację głównego białka zapalenia (NF-κB) do jądra komórkowego mikrogleju ludzkiego – HMC3 (pomarańczowa strzałka) poddanych działaniu AgNPs o małej średnicy. Komórki nie poddane działaniu AgNPs nie wykazują zjawiska translokacji (biała strzałka). Zdjęcia wyk. Dr B. Skóra.
Mechanizm działania nanocząstek srebra w komórkach człowieka jest zazwyczaj taki sam (niezależnie od tkanki) i obejmuje indukcję stresu oksydacyjnego, jako efekt nadprodukcji reaktywnych form tlenu (ang. reactive oxygen species, ROS), skutkiem czego jest uruchomienie wewnątrzkomórkowych mechanizmów ich neutralizacji. Jednak najczęściej jest to działanie nieskuteczne, prowadzące bezpośrednio do śmierci komórki z zaangażowaniem ścieżki apoptotycznej – czasami również nekrotycznej. Badania prowadzone na świecie, ale także w Katedrze Biotechnologii i Biologii Komórki WSIiZ, udowadniają, że AgNPs o małych rozmiarach zaburzają wewnątrzkomórkową równowagę redox związaną z działaniem mitochondrium, czy innymi szlakami (np. SHH, PPARγ, AhR) w komórkach. Wywołując zawsze negatywny wpływ na komórki, które mają kontakt z tego typu nanostrukturami. Szczególnie niepokojące w tym kontekście są badania prowadzone w okresie ostatnich 2 – 3 lat, które pokazują, że AgNPs o średnicy do 20 nm, są w stanie przechodzić przez wysoce-selektywną barierę krew-mózg (ang. blood-brain barier, BBB). Stanowi to zagrożenie dla komórek nerwowych i jest potencjalnym czynnikiem pro-neurodegeneracyjnym. Badania prowadzone przeze mnie w tym zakresie pokazują również niebezpieczeństwo związane z indukcją chronicznego zapalenia wywoływanego przez AgNPs w komórkach mikrogleju. Pomimo, że podejmowano próby ograniczania toksyczności AgNPs oraz zwiększenia ich selektywności w stosunku do komórek nowotworowych (m.in. przez pracowników KBiBK) – ryzyko akumulacji tego typu nanostruktur w ciele człowieka jest stosukowo wysokie i może stanowić czynnik, dla którego efekty negatywne mogłyby przewyższyć korzystne.
Literatura:
Skóra B, Piechowiak T, Szychowski KA (2023) Dual mechanism of silver nanoparticle-mediated upregulation of adipogenesis in mouse fibroblasts (3T3-L1) in vitro. Toxicol Appl Pharmacol 479:116726. doi: 10.1016/j.taap.2023.116726
Skóra B, Piechowiak T, Szychowski KA (2024) Engagement of specific intracellular pathways in the inflammation-based reprotoxicity effect of small-size silver nanoparticles on spermatogonia and spermatocytes in vitro cell models. Chemosphere 363:142897. doi: 10.1016/j.chemosphere.2024.142897
Skóra B, Matuszewska P, Masicz M, Sikora K, Słomczewska M, Sołtysek P, Szychowski KA (2023) Crosstalk between the aryl hydrocarbon receptor (AhR) and the peroxisome proliferator-activated receptor gamma (PPARγ) as a key factor in the metabolism of silver nanoparticles in neuroblastoma (SH-SY5Y) cells in vitro. Toxicol Appl Pharmacol 458. doi: 10.1016/j.taap.2022.116339
Ayala-Núñez NV, Lara Villegas HH, del Carmen Ixtepan Turrent L, Rodríguez Padilla C (2009) Silver Nanoparticles Toxicity and Bactericidal Effect Against Methicillin-Resistant Staphylococcus aureus: Nanoscale Does Matter. NanoBiotechnology 5:2–9. doi: 10.1007/s12030-009-9029-1