Mgr inż. Dominika Szlachcikowska
Pracownik Katedry Biotechnologii i Biologii Komórki Wyższej Szkoły Informatyki i Zarządzania w Rzeszowie. Absolwentka studiów na kierunku Biotechnologia na Uniwersytecie Rzeszowskim o specjalizacji biotechnologia analityczna (studia inżynierskie) oraz biotechnologia molekularna (studia magisterskie). W centrum jej zainteresowań są szeroko pojęte nauki przyrodnicze, piesze wędrówki oraz rozgrywki włoskiej ekstraklasy – Serie A.
Twoje ciało jest młodsze niż myślisz
To wiadomość, która z pewnością wywoła wiosnę w sercu każdego, kto obawia się swoich kolejnych urodzin – jesteśmy znacznie młodsi, niż nam się wydaje! Ciągła regeneracja naszych komórek i tkanek oznacza, że znaczna część naszego ciała jest od naszego rzeczywistego wieku młodsza o tygodnie, lata, a nawet …dekady. Szacuje się, że ciało ludzkie składa się z około 37 bilionów komórek, z czego codziennej wymianie ulega około 330 miliardów, co stanowi 1 procent wszystkich komórek ciała [2].

Fot.1 Stułbia pospolita
Regeneracja to proces zastępowania lub przywracania do pełnej funkcjonalności uszkodzonych lub brakujących komórek, tkanek czy narządów. Niektóre zwierzęta wykazują rozległe zdolności regeneracyjne. Przykładem może być niewielka słodkowodna stułbia, której większość ciała zbudowana jest z komórek macierzystych oraz niewielkiej liczby w pełni zróżnicowanych komórek.
Po uszkodzeniu lub przecięciu jej ciała na dwie części, obumierające komórki wysyłają sygnał do komórek sąsiednich, co stymuluje powstanie nowych, niezbędnych do zastąpienia utraconych części ciała [1]. Zjawisko to nosi nazwę morfalaksji – regeneracji całego organizmu z drobnych odcinków ciała. U ssaków, w tym także u ludzi możliwości regeneracyjne, czyli zdolność tkanek do tworzenia utraconych struktur, są ograniczone. Komórki w ludzkim organizmie wymieniane są średnio co 7 do 10 lat, lecz za tymi liczbami kryje się ogromna zmienność długości życia różnych komórek ciała [7].
Jak określić tempo odnowy komórek w różnych tkankach naszego ciała?
W przypadku szybko odnawiających się tkanek przydatne mogą być metody znakowania wykorzystujące analog nukleotydu tymidyny – BrdU (bromodeoksyurydynę). Niestety w przypadku powoli dzielących się komórek technika ta okazuje się nieskuteczna. Rozwiązaniem problemu jest metoda szacowania wieku komórek na podstawie datowania radioizotopowego, które wykorzystał szwedzki zespół badawczy, kierowany przez Jonasa Friséna, z Karolinska Institute w Sztokholmie. Rozwiązanie to jest powszechnie używane w archeologii oraz paleontologii do określania wieku skamieniałości.
Wspomniany sposób datowania wykorzystuje wysoką zawartość izotopu węgla 14C w atmosferze, będącą skutkiem nadziemnych prób broni jądrowej przeprowadzanych w latach 50-tych ubiegłego wieku. Wybuchy podwoiły ilość izotopu węgla 14C w atmosferze, który systematycznie pobierany był przez rośliny z powietrza. Stamtąd trafił do organizmów zwierząt zjadających rośliny – w tym ludzi.
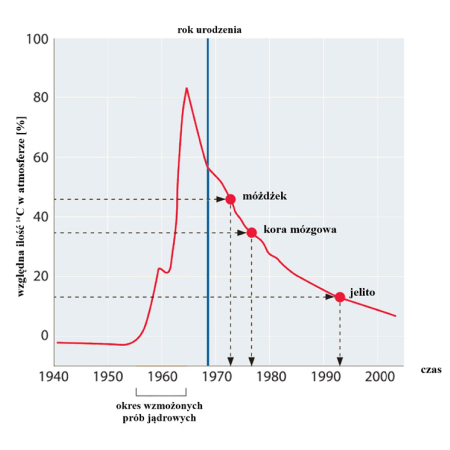
Fig.1 Wnioskowanie o tempie zastępowalności komórek na podstawie znakowania stabilnych izotopów. Globalne poziomy 14C w środowisku są pokazane na czerwono. Wysoki wzrost poziomu radioizotopu w latach 1955–1963 jest wynikiem wzmożonych testów nuklearnych. Wiek komórek móżdżku, kory potylicznej i jelita cienkiego wywnioskowano z analizy poziomów 14C w genomowym DNA. Rok urodzenia dawcy komórek jest oznaczony pionową linią. Badanie przeprowadzono w latach 2003-2004. Na podstawie K. L. Spalding i in., Cell, 122:133-143, 2005.
W procesie datowania metodą węgla 14C analizowany jest stosunek zawartości izotopu węgla 14C, do ilości stabilnego, powszechnego izotopu 12C w DNA komórki. Stosunek ten w momencie jej narodzin odpowiada zawartości radioizotopu w atmosferze. W naszych ciałach zostaje on włączony do DNA każdej powstającej komórki, a jego poziom nie ulega zmianie, gdyż kwas deoksyrybonukleinowy nie jest wymieniany przez całe jej życie. Zawartość 14C w DNA kształtowana jest zatem w chwili jej powstania. Po śmierci proporcje zmniejszają się, ponieważ radioaktywny węgiel ulega rozpadowi. Mierząc frakcję tegoż izotopu, można wywnioskować datę powstania pojedynczej komórki z dokładnością do dwóch lat, a to stanowi podstawę do określenia tempa odnowy tkanek w organizmie człowieka [7].
Każdy rodzaj tkanki charakteryzuje się pewnym okresem obrotu metabolicznego, przynajmniej częściowo związanym z obciążeniem tworzących ją komórek. Korzystając z tej oraz innych metod datowania, wywnioskowano, że około 10% ludzkich komórek tłuszczowych ulega odnowie każdego roku [3]. Komórki naskórka odnawiają się co mniej więcej dwa tygodnie. Krwinki czerwone, nieustannie przemieszczające się w układzie krążenia, żyją zaledwie 120 dni [11]. Komórki mięśni szkieletowych żyją około 15 lat [7]. Z kolei okres obrotu metabolicznego dorosłego ludzkiego hepatocytu, czyli komórki wątrobowej – wynosi od 300 do 500 dni [8]. Komórki nabłonka jelita cienkiego obumierają po około czterech dniach – są one zaliczane do najbardziej krótkowiecznych komórek ciała, podczas gdy niektóre komórki w ogóle nie ulegają wymianie [9]. Należą do nich m.in. komórki tworzące soczewki w naszych oczach. Badania komórek mózgu, przeprowadzane na materiale pobranym z kory wzrokowej, tkanki odpowiedzialnej za przetwarzanie obrazu, wykazały, że wszystkie komórki miały taki sam wiek jak organizm, z którego pochodziły, co potwierdza hipotezę, że ten rodzaj komórek nie ulega regeneracji [7]. Co ciekawe, neurony ssaków nie ulegają również starzeniu replikacyjnemu, a przy braku stanów patologicznych ich żywotność jest ograniczona jedynie maksymalną długością życia organizmu [10].
Tab. 1 Tempo odnowy komórek w różnych tkankach ludzkiego ciała.
| Typ komórki | Długość życia komórki |
| Nabłonek jelita cienkiego | 2-4 dni |
| Komórki układu odpornościowego | 1-5 dni |
| Komórki naskórka | 10-30 dni |
| Krwinki czerwone | 90-120 dni |
| Komórki kościotwórcze | 3 miesiące |
| Komórki wątrobowe | 300-500 dni |
| Komórki soczewki oka | Okres życia organizmu |
| Żeńskie komórki płciowe | Okres życia organizmu |
| Komórki kory mózgowej | Okres życia organizmu |
Co ciekawe, w 2013 roku zespół naukowców z Uniwersytetu w Pawii we Włoszech wykazał, że komórki mózgowe myszy mogą przeżyć dłużej niż ich ciała. W swoim badaniu naukowcy przeszczepili neurony myszy do mózgów szczurów i zaobserwowali, że przeszczepione komórki żyły tak samo długo jak biorcy komórek. Zatem długość życia neuronów nie jest ograniczona maksymalną długością życia organizmu dawcy, ale trwa po przeszczepieniu do dłużej żyjącego gospodarza [6].
Niezależnie od tego, jak „młoda” jest nasza skóra, kości czy wątroba, z biegiem lat czujemy się starsi ze względu na nasz realny wiek biologiczny. To on odzwierciedla reakcję organizmu na upływ czasu. Mimo ciągłej odnowy komórek, narządy wciąż się starzeją m.in. z powodu kumulowania się w DNA mutacji, które upośledzają funkcje komórek i prowadzą do starzenia organizmu. Zatem mimo tego, że komórki w niektórych częściach naszego ciała są stosunkowo młode, nasze starzejące się, często „kopiowane” DNA sprawia, że czujemy ciężar upływających lat.
Bibliografia:
- Reddy PC, Gungi A, Unni M. Cellular and Molecular Mechanisms of Hydra Regeneration. Results Probl Cell Differ. 2019;68:259-290. doi: 10.1007/978-3-030-23459-1_12. PMID: 31598861; PMCID: PMC7116057.
- Roy AL, Conroy RS. Toward mapping the human body at a cellular resolution. Mol Biol Cell. 2018 Aug 1;29(15):1779-1785. doi: 10.1091/mbc.E18-04-0260. PMID: 30058989; PMCID: PMC6085824.
- Spalding, K., Arner, E., Westermark, P. et al. Dynamics of fat cell turnover in humans. Nature 453, 783–787 (2008). https://doi.org/10.1038/nature06902
- Pantaleo A, Giribaldi G, Mannu F, Arese P, Turrini F. Naturally occurring anti-band 3 antibodies and red blood cell removal under physiological and pathological conditions. Autoimmun Rev. 2008 Jun;7(6):457-62. doi: 10.1016/j.autrev.2008.03.017. Epub 2008 Apr 21. PMID: 18558362.
- Bergmann O, Bhardwaj RD, Bernard S, Zdunek S, Barnabé-Heider F, Walsh S, Zupicich J, Alkass K, Buchholz BA, Druid H, Jovinge S, Frisén J. Evidence for cardiomyocyte renewal in humans. Science. 2009 Apr 3;324(5923):98-102. doi: 10.1126/science.1164680. PMID: 19342590; PMCID: PMC2991140.
- Magrassi L, Leto K, Rossi F. Lifespan of neurons is uncoupled from organismal lifespan. Proceedings of the National Academy of Sciences of the United States of America. 2013 Mar;110(11):4374-4379. DOI: 10.1073/pnas.1217505110. PMID: 23440189; PMCID: PMC3600460.
- Spalding KL, Bhardwaj RD, Buchholz BA, Druid H, Frisén J. Retrospective birth dating of cells in humans. Cell. 2005 Jul 15;122(1):133-43. doi: 10.1016/j.cell.2005.04.028. PMID: 16009139.
- Rose S, Ezan F, Cuvellier M, Bruyère A, Legagneux V, Langouët S, Baffet G. Generation of proliferating human adult hepatocytes using optimized 3D culture conditions. Sci Rep. 2021 Jan 12;11(1):515. doi: 10.1038/s41598-020-80019-4. PMID: 33436872; PMCID: PMC7804446.
- Rees WD, Tandun R, Yau E, Zachos NC, Steiner TS. Regenerative Intestinal Stem Cells Induced by Acute and Chronic Injury: The Saving Grace of the Epithelium? Front Cell Dev Biol. 2020 Nov 12;8:583919. doi: 10.3389/fcell.2020.583919. PMID: 33282867; PMCID: PMC7688923.
- Jurk D, Wang C, Miwa S, Maddick M, Korolchuk V, Tsolou A, Gonos ES, Thrasivoulou C, Saffrey MJ, Cameron K, von Zglinicki T. Postmitotic neurons develop a p21-dependent senescence-like phenotype driven by a DNA damage response. Aging Cell. 2012 Dec;11(6):996-1004. doi: 10.1111/j.1474-9726.2012.00870.x. Epub 2012 Sep 12. PMID: 22882466; PMCID: PMC3533793.
- Thiagarajan P, Parker CJ, Prchal JT. How Do Red Blood Cells Die? Front Physiol. 2021 Mar 15;12:655393. doi: 10.3389/fphys.2021.655393. PMID: 33790808; PMCID: PMC8006275.
